仿制药企业进入淘汰赛 一致性评价时短量大
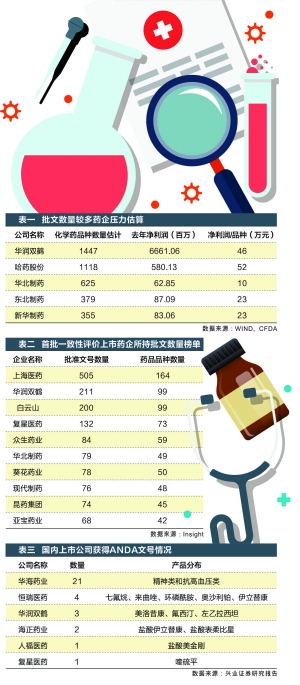 医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。
医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。
-
最红女星日版奶茶妹妹一缺陷被评在中国出不
不知道大家看过一部日本励志电影《垫底辣妹》吗?这部电影于2015年5月1日在日本上映,2016年4月14日在中国上映,...[详细]
-
鹿晗关晓彤关系再升级两人同佩戴同款戒指
鹿晗与关晓彤这对情侣自从公开恋情后经常被友扒出恩爱细节,不过近日鹿晗与关晓彤的关系疑从恋人再升级,两...[详细]
-
明星街拍最美的刘雯樱花树下
此页面是否是列表页或首页?未找到合适正文内容。种猪价格宝宝风寒感冒怎么办婴儿消化不良...[详细]
-
谁能解释一下为什么石原里美顶一个油头也那
本文转载自OinFashion十元妹纸又出新电视剧——是一部以法医为题材的职场电视剧《UNNATURAL》又名《非自然死亡》电...[详细]
-
女性向综艺盘点年龄段全幅化类型多样化垂直
一线导读:女性群体成了观察的主题,而女性观众则成了锁定的目标,但在许多综艺中,女性仍然是 花瓶 角色,且...[详细]
-
农农见老板范玮琪陈建州与陈立农合照笑容满
陈立农范玮琪范玮琪、陈建州与陈立农四人合照 范范范瑋琪 嗨!@陈立农 农农~ 新浪娱乐讯 5月14日,范玮琪[微...[详细]
-
-
永远叫不醒一个不爱你的人
叫不醒不爱你的人一早,我就看到Jane更新的朋友圈:失恋第330天。我这才惊觉Jane失恋都快一年了叫不醒不爱你的人一早,我就看到Jan
-
如懿传江与彬结局
《如懿传》江与彬结局是跟惢心结了婚,并生育了两个孩子,十分恩爱。他在后期依旧在宫中当值,最后跟李玉一起帮如懿惩治了卫嬿婉。与惢心(如懿近
-
山东省教育厅未批复中国胸痛大学正在核查
原标题:山东省教育厅:未批复中国胸痛大学,正在核查近日,一所名为 中国胸痛大学在山东济南成立 的消息引起舆论关注。对此,山东省教育原标题
-
薛之谦与前妻高磊鑫复合深夜爆袭今生只爱一
失眠在大清晨刷出了薛之谦的一条微博!薛之谦微博写道: 我记得 你跟我时 我一无所有 我不想再寻觅了 请让我给你所有失眠在大清晨刷出了薛之
-
鹿晗和壹心娱乐分手解约后真能有钱有爱吗
一线导读:鹿晗同壹心娱乐解约能如此风平浪静,其实是双方早就同床异梦。 有钱有爱 ,是解约后杨思维对鹿晗最大的祝福。但目前,鹿晗一线导读:
-
脱下高定裙穿安踏看完你就知道景甜凭什么撩
昨天,张继科和景甜在微博公布了恋情,体育委员和文艺委员终于在一起了!芭姐仿佛听到了万千张继科太太心碎的声音景甜到底是什么样的女孩,让内敛
-
-
-
天呐谢娜粉丝过亿了专心带娃的马兰坡坡姐原
现如今,明星的微博是与粉丝和友互动的最好的平台,而且一个明星的微博粉丝的多少也决定了一个明星的热度和人气。现如今,很多小鲜肉现如今,明星
-
危险产兆表现形式便意感剧痛
孕妇要到生产前,就会特别的关注自己的产前是危险产兆还是正常产兆,有哪些产兆是危险的呢?孕妇要生产之前是有产兆的,究竟哪些产兆是正常的,哪
-
王迅这就是命破4000万春节档唐探2爆笑
王迅《这就是命》破4000万 春节档《唐探2》爆笑接力王迅主演的贺岁喜剧《这就是命》,凭借出色表现受到观众认可,助推排片连日逆袭,从首王
-
杨幂和蒋依依什么关系
杨幂和蒋依依无血缘关系,只是曾经合作过几部作品而已算同事关系。上说杨幂是蒋依依的姑姑是谣传,如果说二人一定有什么联系,那就是她们都是童星,二
-
上海迪士尼回应天价插队费尊享导览服务非中
资料图:上海迪士尼度假区。中新社发 申海 摄上海迪士尼回应天价 插队费 :尊享导览服务非中国特有央广上海1月3资料图:上海迪士尼度假区。
-
娱圈沦为富豪生子机器的五大女星最后两位无
一、陈婷。做女人有的靠脸蛋,有的靠身材,有的靠智慧、能力等在男人市场取胜,但还有凭着能生子取胜,陈婷和巩俐相比那是天差地别,不可同一、陈
-
-
-
他相貌出众却在装修时意外坠楼身亡年仅25
如今电影行业百花齐放,各个题材的电影都有,而且电影市场也越来越多样化,相比于过去的年代,可以说电影市场正在进步。但是很多观众对于过如今电
-
这部小清新丧尸剧教会我们什么是爱与家庭
周末愉快~今天小妹来为大家讲一个温馨中略带恶心的故事,就是这部小清新丧尸美剧《小镇滋味》。一说到丧尸片,大家脑中是不是都充斥着这样周末愉
-
评脱口秀和嘻哈崛起背后是小众文化的大有可
脱口秀和嘻哈崛起的背后 是小众文化的大有可为 最近,一档新的喜剧脱口秀节目《脱口秀大会》再次将喜剧脱口秀推到了人们关注的风口脱口秀和嘻哈
-
张震出任戛纳电影节评委好的电影是有温度的
张震出任戛纳电影节评委 谈标准:好的电影是有温度的 本报讯 日前第71届戛纳电影节金棕榈主竞赛单元评审团名单公布,中国台湾男张震出任戛纳
-
冉莹颖早前出发纽约时装周娇小身材穿出大长
冉莹颖机场街拍冉莹颖机场街拍冉莹颖机场街拍新浪娱乐讯 日前,邹市明娇妻冉莹颖出发纽约时装周,机场街拍曝光。照片中,冉莹颖身着复古运冉
-
明星一周穿衣红黑榜养眼还是辣眼
原标题:明星一周穿衣红黑榜!养眼还是辣眼?今天吧姐想拿明星的现实穿搭聊一聊~仅限最近的穿衣不管养眼还是失常宝宝们别打我哈
-
-
-
杨幂替身再晒近照罕见露全脸简直和本尊一模
大家还记得在《三生三世十里桃花》中的那个杨幂替身卓亨瑜吗?最近,她又晒了近照,简直是和杨幂一模一样!如果不说这是替身,怕是所有的人大家还
-
最近预购的球鞋清单里必须得有
原标题:最近预购的球鞋清单里,必须得有adidas Originals PROPHERE 3月不知不觉已经过了三分之一,春季的购鞋原标题
-
幸福一家人沈宇航是谁
沈宇航是一名律师,是房天的前男友,两个人曾经谈过一场八年的恋爱。《幸福一家》中,沈宇航结过一次婚,是与房天心分手之后,就选择和另一个
-
鸣人多少集当火影和雏田结婚是哪一集
鸣人,这是火影忍者动漫中的人物了,是很多人都是知道的,那么鸣人多少集当火影?和雏田结婚是哪一集:鸣人多少集当火影:动漫鸣人是没有当上
-
流行色是很美但这些颜色才最值得你投资
流行色是很美 但这些颜色才最值得你投资很多人都喜欢把流行色作为一整年衣柜的主打色,好像今年流行色不穿身上就是OUT,其实有可能穿流行色是
-
张艺谋影在哪里拍的
张艺谋《影》在湖北枣阳拍的,2017年,《影》剧组在枣阳市中国汉城汉宫景区取景拍摄。张艺谋《影》讲述的是一个有关替身的故事,影子境州从八
-
-
-
卫衣有毒12款搭配时髦一年
原标题:卫衣有毒!!12款搭配时髦一年 来源:In风尚(ID:chuanyikk) 每逢换季,早晚温差总让人纠结,到底今天原标题:卫衣有
-
王杰首谈拒参加我是歌手原因与年轻的小弟小
昨天,《歌手2018》第二季终于在万众瞩目中开播了,期待值爆表张韶涵,摇滚巨匠汪峰,极致强音Jessie J,至情音杰李圣杰,还有岁月金声
-
王子文一气读完欢乐颂2
电视剧《欢乐颂2》正在热播, 五美 的情感归属又将走向何方?剧中 曲筱绡 饰演者、当红女星王子文近日拍摄电视剧《欢乐颂2》正在热播,“五
-
妹纸你胸前好像有东西掉出来了旁边的美女都
妹纸,你胸前好像有东西掉出来了,旁边的妹子看呆了!美女,你真漂亮,好美姑娘,都说胸大无脑,但你却怎么一点都不笨啊这技术一般人真来不妹
-
路人偶遇王思聪高调开豪车载美女出行网友调
说起王思聪,大家对他的印象最深就是首富王健林之子。在娱乐圈他有个绰号 娱乐圈纪检委 ,曾经和许多当红大腕公开互怼,热极一时。一说起王思聪
-
微信再发重磅公告这种行为将永久封号
原标题:再发重磅公告!这种行为将被严厉打击,永久封号!近日,公众平台针对部分公众号、小程序存在发布断章取义原标题:再发重磅公告!这种行为
-
-
-
玩游戏赠女朋友超人的这些绝招应该瞧一瞧
腾讯娱乐讯 昨晚的《超人访问团》中,花式台球超人徐杰舞台炫技不含糊,一杆20球再次刷新世界纪录;投篮机超人何翔海化身“豌豆射手”,“定海神贞
-
孙俪早年公交车售票员照清纯可爱
由孙俪主演的电视剧《那年花开月正圆》正在热播中。孙俪演技非常好,无论是什么电视剧只要她主演必火。如:《玉观音》《新上海滩》《甄嬛传由孙俪
-
杨丞琳晒与爱犬自拍对镜头甜笑脸蛋红红超可
杨丞琳与爱犬合影 楊丞琳 她愈老愈有個性。不像以前,拍多久都乖乖的,現在必須速戰速決,免得她沒耐心! 新浪娱乐讯 8月30日,杨丞琳[
-
张艺谋34岁女儿两次婚姻都嫁给老外遭老外
张艺谋的大女儿叫张末,今年34岁,是张艺谋和前妻肖华所生。在张艺谋和巩俐热恋,并和肖华离婚之时,张末正直青春期,非常叛逆。张末对巩俐
-
我愿意用生命爱你却不愿意低头宠坏你
文章来源于新浪看点:唯美成殇爱情真的很奇妙,在某个瞬间,彼此对视一眼,便认定你就是我一生共度的人。但亲爱的,爱情归爱情,却总不能以文章来
-
星巴克回应致癌风波又不是就我一家网友很宽
文|AI财经社 荆文静编|鹿鸣继 吸烟有害健康 之后,恐怕加州市民在喝咖啡的时候,也要伴随 咖啡会致癌 的警告。3月29日,洛杉矶高等法
-
-
-
你知道泰国人妖是怎么上厕所的吗
泰国旅游是中国人比较喜欢比较热门的出境游目的地之 一,泰国旅游局甚至预测2016年全年中国赴泰国旅游的人数将超过1000万人次,这表明中国
-
她是林宥嘉眼里的光怀着孕也依旧超漂亮
最近林宥嘉太太丁文琪在ins上传的自己孕照,上了热搜 画面里丁文琪kiki拍了张自己的孕肚照片,还p上了一个最近林宥嘉太太丁文琪在ins
-
女子急敷面膜去粉刺没看说明把眉毛都撕下来
22岁的菲律宾女子吉妮拉从朋友那里得到了去粉刺面膜,但急于去粉刺的她没有看说明书就使用,结果撕除的时候把眉毛都撕下来了。吉妮拉15分钟2
-
小S素颜安利改善双下巴的方法网友直呼受到
小S安利改善双下巴的方法 小S 改善雙下巴的方法! 新浪娱乐讯 5月24日晚,小S通过微博上传真实可爱视频,并称:“改变双下巴的方法
-
沙海潘子去哪里了
《沙海》中吴邪祭拜的潘子是去了天国,他为了掩护吴邪成功逃离张家古楼而牺牲。生前是吴邪最好的兄弟。吴邪从小到大一直受他关照和保护,他在
-
扬州20多处红色资源可串联成珠业内打造红
抗日战争最后一役纪念馆及胜利广场(资料图片) 原标题:暑期红色旅游升温 游客年轻化 扬州20多处红色资源可串抗日战争最后一役纪念馆及胜利
-
-
-
中韩关系这个重磅信号刚发布韩国上下就沸腾
内容尽管只有寥寥数行,却引发国内外媒体高度关注。其中,对于舆论关切的 萨德 问题,传递出的信息尤为 重磅 。相关部分的原话是这样的内容尽
-
强收新生被褥费学校商家勾结敛财
金秋9月,天气舒适凉爽了起来,也迎来了莘莘学子入学的季节,然而高校却传出了强收新生被褥费,与商家串通分红的事,新生入校头天就被骗,金秋9
-
杨幂Angelababy这些30年前的珍
原标题:杨幂?Angelababy?这些30年前的珍贵照片,秒杀现在的时髦街拍! 时尚是一个轮回 这句话应该很多人都原标题:杨幂?Ang
-
宋喆被判几年因涉职务侵占罪一审获刑6年
2016年8月14日深夜,王宝强的一篇文章使得很多人都无法沉睡,王宝强宣布和结婚多年的马蓉离婚,同时他还宣布将解除宋喆的经纪人职务,时间过去
-
周迅李亚鹏穿黑衣去看窦靖童唱歌音乐节怎么
原标题:周迅、李亚鹏穿黑衣去看窦靖童唱歌,音乐节怎么穿才吸引人? 范主说:换身装备躁起来~ ( 文| 神马牌子原标题:周迅、李亚鹏穿黑衣
-
朴信惠让发型师坑了新剪的刘海好像是戴了个
原标题:朴信惠让发型师坑了?新剪的刘海,好像是戴了个帽子! 韩国女星,在中国还是很有市场的,不管是从造型搭配原标题:朴信惠让发型师坑
-
-
-
张翰成为了过去胡彦斌自曝想和郑爽结婚赶快
文 热门电影君(原创文章,谢绝转载,侵权必究)说到郑爽,很多人就能够立刻想到她在电视剧中天真无邪的笑容,然而如此天真的姑娘,爱情之文/热
-
你的初恋早死在这部电影里了
这部台湾最好的青春片所讲的故事,几乎每天都在中学教室里发生着。 电影名字 蓝色大门 成了影迷们解读的这部台湾最好的青春片所讲的故事,几乎
-
热热热承包蔡依林性感的这条裙子遮肉防晒又
原标题:热热热!承包蔡依林性感的这条裙子遮肉防晒又凉爽! 曾被群嘲时尚雷区的蔡依林,近几年不仅事业风生水起,拖车价格孩子便秘拉不出来
-
左右皆是打一国家中非有几个国家
很多的国家都可以用成语来形容,而成语来猜国家的地名是非常有趣的,那左右皆是打一国家?中非有几个国家?左右皆是打一国家:中非解释:
-
女星欠钱不还被公开追债嫁明星球员老公却屡
债务纠纷是所有人都避之不及的事情,欠债不还是很多人都经历过的事情。不过不仅普通人,明星也会 欠钱不还 。债务纠纷是所有人都避之不及的事情
-
王菲和周迅见面说话吗
王菲和周迅关系并不差,二人见面都十分大度,周迅于2018年9月参加了王菲的节目《幻乐之城》,放出的视频中二人一见面就拥抱,并且笑着聊天,
-
-
-
盛唐幻夜叶远安结局
《盛唐幻夜》小说结局中,穆乐死了只留下叶远安一个人,之后叶远安与赵澜之还有明慧前往下一个案发地点了。《盛唐幻夜》叶远安是户部侍郎长女,喜
-
热巴杨幂显高都靠小腿长王菲坐着都能拍出2
王菲、李嫣坐着都能上热搜? 因为人家腿长有资本啊! 喏??这就是那张引来友们无数尖叫的长腿图,由于 事发突然 ,这对母王菲、李嫣坐着都能
-
吴尊老婆罕见露面抱着儿子跟在吴尊身后
吴尊老婆现身非常低调最近一段时间,吴尊带着自己的女儿还有儿子去参加《爸爸去哪儿5》,在节目里面吴尊的儿子和女儿圈粉无数。特别是吴尊吴尊老
-
中国游客促动国外改收款习惯当地居民享福利
中国出境游,带给世界新气象中国国家旅游局的数据显示,刚刚过去的国庆、中秋 加长版 黄金周,出境游客数预计超过600万人次,分别从中国中国
-
中国最牛帝陵几千年竟然无人敢盗
为什么说黄帝陵是中国最牛的帝陵呢?原因有二,首先它自建立以来,历朝历代无人敢动盗墓念头。曹丕曾经说过一句话 自古及今,未有为什么说黄帝陵
-
杨幂纽约时装周启程你需要一件卫衣开启秋季
时装周进行的如火如荼,wuli大幂幂也要启程时装周啦~作为机场带着真女王,来看看其实还真不常在机场出现的幂幂这次机场私服LOOK吧!
-
-
-
佟卓尧阮曼君在一起了吗
《如若巴黎不快乐》小说中佟卓尧与阮曼君在一起了,电视剧版二人也圆满的在一起了,最终收获了爱情。阮曼君原本是律师,有一个感情不错的男朋友,
-
资本涌入伤害了谁听行业大咖剖析动漫行业现
文 | 广电独家 杨哲;转载请注明作者及来源 4月27日,是第十四届中国国际动漫节开幕第2天,可文 | “广电独家” 杨哲;转载请注明
-
张艺兴将发新专辑花心血从歌曲角度信心12
视频:张艺兴称将发新专辑 新浪娱乐讯 9月9日,第15届BAZAAR明星慈善夜在北京举办。谈到慈善, 暖男 张艺兴[微视频:张艺兴称将发
-
朴树和周迅结婚了吗
朴树和周迅曾经谈过恋爱,但并未结婚。周迅和朴树是拍高晓松的那时花开认识的,二人因为这部戏结缘,之后他们就整天腻在一起,开工也不分开,逼的
-
如懿儿子的下场
《如懿传》如懿一共有两个儿子,一个是十二阿哥永璂,一个是十三阿哥永璟。十三阿哥出生时被卫嬿婉收买的田嬷嬷给捂死了,十二阿哥曾被卫嬿婉下过毒,
-
在重庆架桥有多难一块拦路石要锯两个月
今天我们来聊一聊 两江大桥 之一的千厮门嘉陵江大桥。千厮门大桥起于渝中区沧白路,横跨嘉陵江而过,止于江北城金沙路,主桥全长720今天我们
-
-
-
小S晒和老公享受烛光晚餐网友大赞其老公又
小S(徐熙娣)和老公许雅钧(Mike)感情一直都很好,虽然外界曾传他们夫妻俩感情有过破裂,但事实证明2人并没小S(徐熙娣)和老公许雅钧(
-
镇江警方侦破国内最大网站侵犯著作权案
迅播影院 等一批站被依法查处 最新影视大片上映后,不少人都会选择去影院观赏,或者等购买版权的电视台及视频站播出。但是,“迅播影院”等一批
-
袁姗姗大变身不知道是不是装了开关说瘦就瘦
2017年10月7日,上海,袁姗姗现身机场。身穿藏青色系带毛衣裙,玩儿起下身失踪,来感受下这双吸精的大长腿, 不规则拼接毛衣裙个性气质,
-
哪那么多情人节不过是找个借口对你好
情人节01。前几天收到一个七夕礼物,Apple Macbook Pro。老SU小心翼翼地把它奉上来,语重心长情人节01。前几天收到一
-
无痛分娩一般多少钱哪些人不适合
我们都很喜欢宝宝。可是生宝宝时所受的疼痛总是让人恐惧。无痛分娩能减轻生宝宝的痛苦,那你知道无痛分娩一般多少钱?哪些人不适合?无痛分娩一般
-
重庆饭店靠出租门厅维持生计金字招牌奄奄一
原标题:重庆饭店靠出租门厅维持生计,金字招牌奄奄一息! 重庆饭店靠出租门厅维持生计,金字招牌奄奄一息! 楼原标题:重庆饭店靠出租门厅维持
-
-
-
沈梦辰抢到颖儿捧花网友呼叫杜海涛秒变催婚
沈梦辰抢到颖儿捧花新浪娱乐讯 5月15日,付辛博[微博]颖儿[微博]婚礼在巴厘岛举办。当天婚礼仪式温馨浪漫,两人更现场拥吻落泪,十分
-
牛仔裤款式搭配图片破洞直筒喇叭小脚裤
说起牛仔裤,几乎每个人的衣橱中都有那么一两条,牛仔裤的款式可是有很多种,不同款式的牛仔裤有着不同的搭配方法,先要知道牛仔裤都有哪些款式。
-
日本女神安室奈美惠宣布隐退网友感叹一个时
安室奈美惠 明星资讯,据台湾媒体报道,日本天后安室奈美惠纵横歌坛25年,唱出许多经典作,是许多人心中不可撼动的女神。她先前丢下震安室奈美
-
郑秀文晒红唇诱惑照庆祝开工化身西部牛仔
此页面是否是列表页或首页?未找到合适正文内容。人流后恢复要多久盐城网站优化,如何让你的网站排名居高不下7个月宝宝感冒咳嗽流鼻涕怎么办
-
细数女人的爱你的表现
爱情把妹的时候,女人的心让人捉摸不透,让很多男生无从下手,把妹最后的结果是一无所获,一个人爱情把妹的时候,女人的心让人捉摸不透,让很多男
-
赵丽颖林更新粉丝因一路人开撕CP粉变撕逼
前些日子,林更新和赵丽颖因为《楚乔传》中的 星月夫妇 吸引了一大批CP粉。两家都有很多粉丝,他们不仅把林更新和赵丽颖在电视剧里的剧情前些
-
-
-
吴昕和潘玮柏传绯闻以后时尚感大增晒照呼唤
吴昕自从和潘玮柏一起拍摄《我们相爱吧》,时尚感大增。8月26日,她又在微博晒出一组时尚照。自称喜欢第二张,还号召友为她打call。估计
-
野猪接连咬伤5名村民按野猪肇事险赔偿
村民遭野猪袭击原标题:云南永善野猪袭击致5村民受伤 当地已成立应急工作队云南讯( 熊强)近日,云南永善县村民遭野猪袭击原标题:云南永
-
王子文挽起裤脚玩撞色一双小白鞋走天下
橘子君昨天刚写过一篇王子文的,今天忍不住又来了,真是没办法,这个小妖精每次造型都很有看头。大家都知道曲妖精本人娇小可爱,她的造型几乎都围
-
斯图尔特露皮塔与娜奥米
《霹雳娇娃》敲定了 铁三角 阵容 讯(文 耷子)正在筹备中的《霹雳娇娃》(Charlie s Angels ),今日终于完全敲定了 铁三角
-
鹿晗公布恋情之后你还会继续爱他吗给我一个
昨天鹿晗突然之间一条微博打破长空,鹿晗突然的恋爱了!恋爱的女友还是娱乐圈著名小花关晓彤,顿时各大社交络一片哗然!鹿晗恋爱了!真的昨天鹿晗
-
网友机场偶遇戚薇李承铉一家三口李承铉推着
3月23日早晨,有友在上海浦东国际机场偶遇李承铉戚薇一家三口,该友写道: 妈呀,在机场偶遇戚薇和李承铉,如果看我哥哥有这人品3月23日早
-
-
-
漫威庆典复联3主创竟站边上本土歌手站C位
昨日,复联3主创出席了上海的红毯仪式。主办方晚上举办了一个 漫威十周年庆典 活动,还请来了陈奕迅、张杰、张靓颖、昨日,复联3主创出席了上
-
你都知道吗在这个世界上有这几个微型国家
五、巴拿马 巴拿马面积7 54万平方公里,比重庆市还小,人口只有370万。 1914年修通的巴拿马运河,全长81 3公里,宽150米至30
-
王心凌私密照外泄官司进展姚元浩快闪2句话
姚元浩新浪娱乐讯 据台湾媒体报道,王心凌私密照外泄,掌镜者兼旧爱姚元浩不仅委任律师报警处理,还喊话希望王心凌念在两人过去情份提告,姚元浩
-
中国空间站核心舱首亮相
原标题:独家视频!中国空间站核心舱首亮相!在韩国平昌冬奥会闭幕式上,中国作为2022年冬奥会东道主进行了8分钟表演,期原标题:独家视频!
-
王俊凯和王源是亲兄弟吗
王俊凯王源并非是亲兄弟。王俊凯是TF家族第一批练习生,王源是第二个加入的成员,虽然二人加入时间不一样,但他们都属于第一批练习生,随着训练
-
这些上过快乐大本营的女星现如今都红透了娱
《快乐大本营》作为一档已经具有19年历史的综艺节目,对每个中国人来说,想必都是无人不知无人不晓,曾经有很长一段时间, 快本 蝉联了国《快
-
-
-
医生在患者肝脏上烙印字母SB称做个纪念
英国伊莉莎白女王医院一名外科医生数年前在替病患进行完肝脏手术后,竟在病患的肝脏上烙印自己的名字缩写SB留念。周三,这英国伊莉莎白女王医院
-
重庆九龙坡将举行千年禅林福地春季茶会4月
原标题:重庆九龙坡将举行千年禅林福地春季茶会 4月20日与你相约华岩 春日与茶相遇,享春光品春茶。今日,获原标题:重庆九龙坡将举行千年禅
-
明星拍戏发生意外悲惨瞬间让人心疼无比
2005年,林志玲来到大连拍广告,因为缺乏骑马经验,没有抓紧缰绳,导致从马的右侧摔下,造成6根肋骨骨折,让人无比心疼李依馨在拍戏时脸部被
-
周一围否认与神秘女子烧香发声明称和朱丹感
周一围和神秘女子烧香这个话题再次引起了不少的关注,但是据周一围方面回应称,这个消息是不实消息,并没有神秘女子这一说,当时身边的人是他和朱丹的
-
曝九寨沟突发地震女星安以轩成都失联急坏粉
文章简介:曝九寨沟突发地震 女星安以轩成都失联急坏粉丝,8日晚间四川九寨沟突发地震,女星安以轩恰好在成都工作,引来不少粉丝和友的文章
-
杨千嬅时隔17年再拍TVB剧周柏豪黄浩然
TVB重头剧《多功能老婆》昨日举行发布会,该剧由香港著名女性编剧陈宝华担任总监制,陈宝华曾是TVB编剧,代表作有TVB剧《我本善良》、T
-
-
-
张扬不回应但他对爱情的态度都交代在这部片
“我们结婚吧!”前些天一篇爱情挽歌《张扬导演,我爱你》刷爆了朋友圈,作者是一位名为“小二姐”的女文青,自曝与张扬导演发生了婚外情,但在她
-
杨子女儿考取哈佛微博报喜晒美照颜值智商并
杨子女儿考取哈佛微博报喜晒美照 颜值智商并存4月22日,杨子通过微博报喜,称女儿考取了哈佛,写道: 宝贝女儿报喜:考杨子女儿考取哈佛微博
-
网曝霍启刚郭晶晶泰国度假不带孩子享受二人
4月18日上午,有友在微博爆料在泰国机场偶遇霍启刚与郭晶晶,二人穿着黑白情侣装出游度假,并没有带孩子,甜蜜享受二人世界。 霍4月18
-
要狗你是什么意思不荣艺组合深夜发糖
自从李荣浩知道“狗”这个饭圈用词后,就一发不可收拾,什么情况都能“狗”一下,10月17日,李荣浩在自己微博中宣传新专辑,张艺兴在其微博下
-
樱花曲奇做法步骤
手工曲奇饼干起源于上世纪80年代,因其制作过程十分有趣外加口味独特,深受女孩的喜爱,从欧美传入中国,经过漫长的改良过程,如今做法已越来越简单
-
现在真是喜欢谁谁出事网友我不配喜欢明星
近一个月以来,娱乐圈频频有,林心如、薛之谦,甚至大家喜欢的鹿晗也成为了绯闻制造者,你是不是有点愤怒呢?更有人称喜欢谁谁出事,自近一个月以
-
-
-
心喜文化正式起航陈羽凡陈楚生等助阵
心喜文化正式起航 众咖聚首开启音乐新格局 23日,心喜文化发布会在北京举行,心喜文化创始人兼CEO袁涛出席发布会并致词。本次发布心喜文化
-
最美的情感是我习惯有你
奋斗不应该在该奋斗的年纪,去选择偷懒,只有度过了一段连自己都被感动了的日子,才会变成那个最奋斗不应该在该奋斗的年纪,去选择偷懒,
-
张雪迎出席活动捧腹大笑偶像包袱全丢放飞自
6月10日,张雪迎在上海出席活动。当天她加深橘色眼影+浓厚粉底,妆容看上去 emmm,略微有些雷人了。6月10日,张雪迎在上海出席活动。
-
男人有多少存款才不会被女人看不起
文章来源于新浪看点:苏小邪读者来信:小邪你好,看了你公众号的文章,觉得有些感触。我今年都27岁了,但是仍然在感情上毫无进展,以前在大文章
-
奚梦瑶与何猷君全家出游赌王四太直言有上进
4月3日,有友在曼谷偶遇超模奚梦瑶与赌王儿子何猷君,同游的还有四太梁安琪,哥哥何猷亨,姐姐何超盈,俨然一副 准儿媳陪婆婆出游4月3日,有
-
明星们不为人知的怪癖热巴的竟然是这个
心中有爱,看世界的眼睛才会纯净,感觉世界很温暖;心中有恨,看世界的眼睛也会有杂质,世界也会变丑恶。心态变了,世界也跟着变。生活的好心中有
-
-
-
另类冒险游戏埃尔罗伊和外星人年底上架同步
另类冒险游戏《埃尔罗伊和外星人》年底上架-同步推资讯另类冒险游戏《埃尔罗伊和外星人》年底上架文章概要:另类搞怪冒险游戏,点击式冒险与解谜
-
苹果下坡到何时iPhone7能否力挽狂澜
苹果下坡到何时,iPhone7能否力挽狂澜?布斯去世之后,苹果的创新能力正在枯竭,精益求精的执着也正在消失作为一家以领导为主导核心的
-
s将word文档转化为PDF格式方法
WPS文档能够直接将word文档的.doc格式直接转化成PDF格式,这戈功能对办公1族匙非常方便的,囻货当咨强,接下来笔者给跶家讲授1下wp
-
月季冬季室外扦插技术
月季冬季室外扦插技术月季冬季室外扦插技术1 插条处理在10月中旬至11月上旬,结合月季越冬修剪选节间匀称、隐芽充实的枝条,去掉叶
-
春白菜的种植的要点
春白菜的种植的要点春白菜的种植的要点一、选择适宜品种 为防止春白菜发生先期抽薹,选用冬性强的抗抽薹品种是栽培成功的关键。目前较适宜的
-
枸杞园发生瘿螨危害怎么办
枸杞园发生瘿螨危害怎么办枸杞园发生瘿螨危害怎么办一、危害症状 瘿螨主要危害枸杞叶片、嫩梢、花蕾和幼果,被害部位形成黄绿色圆形隆起的虫
-
-
-
隐瞒十年的秘密赵丽颖坦言最爱的人是他
都知道前段时间《楚乔传》正在各大荧幕上热播,相信大家早已被赵丽颖主演的楚乔演技深深所折服吧!不过,整部剧最让人期待的就是她与男主之都知道
-
再也不会同台的6对明星郑爽张翰遗憾
杨洋和宋茜曾经传出绯闻,但是后来双方都没有承认,后来宋茜出来撕杨洋的助理,杨洋和宋茜的关系就这么冷了下来,后来再也没见过他们同台过杨洋和
-
男子卖了老乡儿子买酒隐匿20余年终于现身
卖了老乡儿子买酒原标题:男子抱走老乡儿子卖了 200 元买酒喝,22 年后终获刑22年前,为了买酒喝,他把老乡半岁的儿子卖了老乡儿子买酒
-
我给你2万你给我介绍个身价过亿的男性吧
相亲前段时间被刷屏的985相亲鄙视链,再一次把 相亲 这两个字推到了话题榜。关于相亲,上流相亲前段时间被刷屏的985相亲鄙视链,再一次把
-
娄艺潇庆生邓家佳画面有爱爱情公寓友情延至
邓家佳发现娄艺潇5月17日晚,娄艺潇在上发布了一条视频,视频内容是娄艺潇给寿星邓家佳准备了惊喜,结果却在悄悄过马路邓家佳发现娄艺潇5
-
周冬雨新戏搭档任达华角色延续以往灵动性格
《魔都风云》登陆湖北卫视 周冬雨任达华演绎上海滩喋血父女情 4月11日起,50集年代传奇抗日剧《魔都风云》重磅登陆湖北卫视。该剧《魔都风
-
-






















